نانوکاتالیست
فهرست مطالب
پیش از بحث درباره نانوکاتالیست، باید با تعریف کاتالیست و انواع آن آشنا شویم.
کاتالیست، کاتالیزور یا کاتالیزگر، به مادهای گفته میشود که اگر به مخلوط واکنش اضافه شود، سرعت رسیدن ماده به حالت تعادل را بدون آن که خودش دچار تغییر شیمیایی شود افزایش میدهد. کاتالیزورها را بعد از مصرف و در انتهای واکنش، میتوان مجددا به دست آورد اما ممکن است از نظر فیزیکی تغییر کرده باشند.
کاتالیزورها به دو دستهی همگن (Homogeneous) و ناهمگن (Heterogeneous) طبقه بندی میشوند
در یک کاتالیزور همگن، مادهای که به عنوان کاتالیزور استفاده میشود همراه با واکنش دهندهها در یک فاز هستند اما در یک کاتالیزور ناهمگن، واکنش دهندهها و کاتالیزور در دو فاز مجزا قرار دارند.
کاتالیزور مناسب، کاتالیزوری است که فقط باعث تولید یک محصول شود و به صورت گزینشی عمل کند. کاتالیزور نامناسب، کاتالیزوری است که توسط آن، محصولات متفاوتی امکان تشکیل داشته باشند.
هر کاتالیست دارای عمر مفید بوده و با گذشت زمان از میزان فعالیت آن در واکنش کاسته میشود. به واسطه داشتن نقاط فعال روی کاتالیزور، این نقاط به مرور زمان غیرفعال شده و درنهایت باعث ایجاد لایهای از ماده واکنش دهنده بر روی کاتالیزور میگردند، در نتیجه ساختار کاتالیزور تغییر یافته، و جذب ناخالصیها در نقاط فعال افزایش مییابد.
مهمترین کاربرد کاتالیزورها
- صنعت نفت و گاز
- صنعت پتروشیمی
- مبدلهای کاتالیزوری اتومبیل
برخی از ویژگیهای مهم یک کاتالیزور
- فعالیت بالا
- داشتن مساحت سطحی بالا
- داشتن گرمای جذب سطحی متوسط
- مقاومت مکانیکی بالا
- عدم سایش و خراش
- عدم تغییر آرایش
- عملکرد مناسب در دماهای متفاوت
- گزینش پذیری بالا
- محصولات جانبی کم
- عمر مفید زیاد
همزمان با رشد صنعت، استفاده از کاتالیستهای موثرتر در محیط زیست و صنایع شیمیایی برای کاهش آلودگی و کاهش هزینهی تولید اهمیت بالایی یافته است. کاتالیستها جزء نخستین کاربردهای نانوفناوری در مقیاس صنعتی بودهاند.
کاتالیستها، به عنوان یک مادهی واسط، در مسیر انجام واکنشهای شیمیایی هستند که باعث تشکیل انتخابی محصولات مورد نظر با سرعتهای قابل توجه میشوند.
نانوکاتالیست
نانوکاتالیست یا نانوکاتالیزگری ترکیبی از دو زمینه کاتالیزگری و نانوفناوری است.
نانوکاتالیستها در مرز بین کاتالیزورهای همگن و ناهمگن ایستاده اند. به این معنا که در بسیاری از موارد مزایای هر دو را از نظر فعالیت، انتخاب پذیری، کارایی و قابلیت استفاده مجدد ارائه میدهند.
در سالهای اخیر از پیشوند نانو در مطالعات کاتالیستی استفاده میشود. اصطلاح نانوکاتالیست یا نانوکاتالیزگری به صورت یک فرآیند کاتالیستی شامل نانوذرات فلزی، خوشههای آنها و اکسیدها یا ترکیبات دیگر که در ابتدا در محیط واکنش قرارداده شده یا در نتیجهی محصولات واکنش تشکیل شدهاند، تعریف میشود.
از آنجا که نانوذرات نسبت سطح به حجم زیادی نسبت به مواد فله دارند، کاندیدهای جذابی برای استفاده به عنوان کاتالیزور هستند. کاتالیزورهای مبتنی بر نانومواد (نانوکاتالیست)، معمولا کاتالیزورهای ناهمگن هستند، که شامل نانوذرات فلزی میباشند، به واسطه نانوذرات فلزی فعالیت کاتالیزوری افزایش مییابد. معمولا کاتالیزورهای نانوذره تحت شرایط ملایم، برای جلوگیری از تجزیه نانوذرات استفاده میشوند.
به طور کلی هدف اصلی تحقیقات نانوکاتالیز شامل تولید کاتالیزورهایی با گزینش 100%، فعالیت بسیار بالا، مصرف انرژی کم و طول عمر زیاد میباشد که این امر تنها با کنترل دقیق اندازه، شکل، توزیع فضایی، ترکیب سطح و… امکان پذیر است.
علم نانو و فناوری نانو، از کاتالیزورهای همگن و ناهمگن کلاسیک نیز فراتر رفته و کاتالیستهایی را توسعه دادهاند که خواص و عملکرد بی نظیری از خود نشان میدهند. کاربردهای کاتالیزوری برجسته در شیمی پایدار، بر تولید مواد شیمیایی فله و ریز در پالایشگاههای کلاسیک مبتنی بر نفت و در پالایشگاههای زیستی از زیست توده متمرکز میباشد. حوزه نانوکاتالیز ( به معنی استفاده از نانوذرات برای کاتالیزاسیون واکنشها) طی یک دهه گذشته، هم در کاتالیز همگن و هم ناهمگن، رشد انفجاری داشته است.
کاربردهای بالقوه نانوذرات و نانوکاتالیستها
- به راحتی جدا میشوند و میتوان آنها را بازیافت کرد.
- نانوذرات میتوانند مورفولوژیهای متعددی از جمله نانوکرهها، ورقههای نانو، خوشههای نانو، نانو ذرات و نانوالیاف به نمایش بگذارند این مواد میتوانند کامپوزیت، ترکیبات، آلیاژها یا جامدات عنصری باشند.
- کاتالیستهای نانوذرات (نانوکاتالیستها) برای هیدروژناسیون پیوندهای C-Cl مانند بی فنیلهای پلی کلرید فعال هستند.
- در واکنش هیدروژناسیون آمینهای معطر هالوژنه برای سنتز علف کشها و آفت کشها و همچنین سوخت دیزل بسیار کاربردی هستند.
- دهیدروژناسیون ترکیبات معطر را به خوبی هیدروژناسیون بنزن به سیکلوهگزان کاتالیز میکنند.
- از نانوذرات تثبیت شده با پلیمر میتوان برای هیدروژناسیون سینام آلدهید و سیترونلول استفاده کرد.
| نانو ساختارها | اندازه | کاربردها |
| خوشهها – نانو بلورها – نقاط کوانتومی | شعاع: 1-10 nm | عایقها، نیمه هادیها، فلزات، مواد مغناطیسی |
| نانوذرات دیگر | شعاع: 1-100 nm | اکسیدهای سرامیک |
| نانوسیمها | قطر: 1-100 nm | فلزات ، نیمه رساناها، اکسیدها، سولفیدها، نیتریدها |
| نانوتیوبها | قطر: 1-100 nm | کربن، از جمله فولرنها، کالکوژنیدهای لایهای |
نانومواد از نظر خواص در 6 دسته طبقهبندی میشوند
کاتالیکی (کارایی کاتالیستی بالا از طریق افزایش سطح نسبت به حجم)
الکتریکی (افزایش مقاومت الکتریکی در فلزات، هدایت الکتریکی در نانو کامپوزیتهای مغناطیسی)
مغناطیسی (افزایش فشار مغناطیسی تا رسیدن به اندازهی دانهی مناسب)
مکانیکی (افزایش سختی فلزات و آلیاژها، شکل پذیری، انعطاف پذیری فوق العاده)
نوری (تغییر طیف به جذب نوری و خواص فلئورسانس، افزایش کارایی کوانتومی از کریستالهای نیمه هادی)
بیولوژیکی (افزایش نفوذپذیری از طریق موانع بیولوژیکی مانند غشاها)
تولید نانوذرات به دو روش اصلی از بالا به پایین یا از پایین به بالا انجام میشود
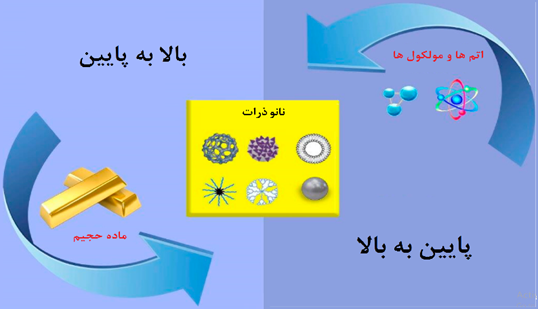
روش بالا به پائین در سنتز نانوذرات
در این روش مواد توده ای بزرگتر با عملیاتی از قبیل شکستن، برش دادن و جدا کردن قطعاتی از آنها به مواد کوچکتر تبدیل شده و در طی این فرآیند، مقدار قابل توجهی انرژی مکانیکی، حرارتی و شیمیایی برای جدا کردن لایهها از ساختار توده ای و تبدیل آنها به نانو ذرات مورد نیاز است.
این روش در مقایسه با روش پایین به بالا غیر قابل کنترل میباشد، زیرا باعث تولید دامنهی وسیعی از نانوذرات میشود و مقیاس پذیر بوده و در مقیاس صنعتی استفاده میشود.
دو روش متداول بالا به پائین:
1- لیتوگرافی، شامل لیتوگرافی نوری، لیتوگرافی نانو چاپ (NIL)Nanoimprint lithography و لیتوگرافی پرتوالکترونی (EBL)Electron-beam lithography
2- زدایش یا اچ کردن شامل زدایش یونی واکنش پذیر (RIE)Reactive-ion etching و زدایش یونی واکنش پذیر عمیق (DRIE)
روشهای فیزیکی شامل آسیاب کردن و خرد کردن، جزء روشهای متداول برای خرد کردن مواد تودهای بزرگ و پدید آوردن نانو ذرات است.
روش پائین به بالا در سنتز نانوذرات
در این روش با تجمع اتمها تحت شرایط خاص، ساختار اتمی از ابتدا و اتم به اتم تشکیل میشود.
- اغلب این روشها به صورت خودآرایی هستند
- در این روش رشد، به صورت تناوبی شکل میگیرد، در نتیجه شبکههای بلوری تشکیل شده اغلب از مکانیسم هسته زایی – رشد (تشکیل اولیهی یک هستهی کوچک و رشد ساختار از آن)، پیروی میکنند
- اغلب برای کاربردهای خاص و محدود هستند
- برای کاربردهای تجاری و صنعتی مناسب نیستند
- کنترل پذیری بسیار بالا منجر به سنتز محصولاتی میشود که همه ذرات اندازه تقریبا یکسانی دارند
سه روش متداول پائین به بالا:
1- رسوب بخار شیمیایی (CVD)
2- رسوب بخار فیزیکی (PVD)
3- لایه نشانی اتمی (ALD)
روشهای شیمیایی دیگر شامل سنتز به کمک پلاسما، سل ژل، روشهای هیدروترمال و … است که میتوان به واسطهی آنها نانو ذرات را تولید کرد.
برخی از واکنشهای مهم که توسط نانوکاتالیست فلزی انجام میشوند
واکنش هیدروسیلیلاسیون (Hydrosilylation reactions)
کاهش تجمع فلزی طلا، کبالت، نیکل، پالادیوم یا پلاتین با سیلان باعث تولید نانوذرات فلزی میشود که واکنش هیدروسیلیلاسیون را کاتالیز میکنند. از نانوذرات pd با عملکرد BINAP و نانوذرات طلا برای هیدروسیلیل استایرن، در شرایط ملایم استفاده شده است. و مشخص شد که نانوذرات فلزی از نظر کاتالیزور فعالتر و پایدارتر از تجمعهای pd-BINAP غیر نانوذره ای است.

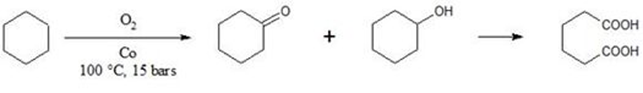
واکنش ردوکس آلی (کاهش اکسیداسیون) (organic redox reaction)
واکنش اکسیداسیون سیکلوهگزان برای سنتز اسید آدیاپیک، میتواند توسط نانو ذرات کبالت کاتالیز شود، که معمولا در مقیاس صنعتی برای تولید پلیمر (نایلون6 و6 ) استفاده میشود. مثالهای دیگر از واکنش اکسیداسیون که توسط نانوکاتالیستهای فلزی انجام میشوند شامل: اکسیداسیون اتن، اکسیداسیون سیکلواکتان و اکسیداسیون گلوکز است.
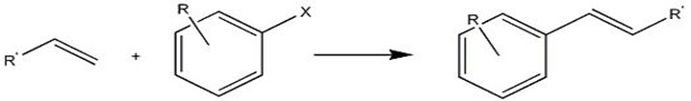
واکنش کوپلینگ هِگ (جفت شدن) کربن- کربن (c-c coupling reactions)
نانو ذرات فلزی میتوانند واکنش کوپلینگ c-c مانند هیدروفرمیلاسیون اُلفینها، سنتز ویتامین E، و واکنشهای جفت شدن هک و کوپلینگ سوزوکی را کاتالیز کنند. نانوذرات پالادیوم به طور موثر واکنشهای جفت شدن هک را کاتالیز میکنند. مشخص شد افزایش بار منفی الکتریکی لیگندها بر روی نانوذرات پالادیوم، فعالیت کاتالیزوری آنها را افزایش میدهد.
مزایای نانوذرات فلزی
- نسبت به حلالها پایدارتر هستند
- نانوذرات فلزی در مایعات، تحت تاثیر نیروی واندروالس قرار میگیرند
- در اثر ترکیب نانوذرات با پلیمرها یا اِلیگومرها میتوان نانوذرات را فعال کرد، در نتیجه با ایجاد یک لایهی محافظتی میتوان از برهمکنش نانوذرات جلوگیری کرد
- آلیاژهای دو فلز که نانو ذرات دو فلزی نامیده می شوند، برای ایجاد اثرات هم افزایی در کاتالیز بین دو فلز استفاده میشود
تولید نانوکاتالیستها
نانوکاتالیستهای فلزی ناهمگن، با جذب نانوذرات بر روی تکیه گاهها آماده میشوند، که شامل استفاده از تکیه گاهها برای جذب نانوذرات روی آنها با تکنیک لیتوگرافی است. امروزه اغلب نانوکاتالیستها به روش تجاری تولید میشوند، و اکثر کاتالیزورهای تجاری، هنوز با مخلوط کردن، تکان دادن و پخت مخلوطی از چند جزء تولید میشوند.
برای صرفه جويی اقتصادی و استفادهی بهینه از نانوکاتالیست، معمولا آن را به صورت کامپوزيت میسازند و اصلاح شیمیایی بر روی سطح آن اعمال میشود. از معایب روش تجاری این است که مقیاس نانو در این روش به خوبی کنترل نمیشود در نتیجه عملکرد ضعیفی دارد.
نانوکاتالیستها به دو دسته همگن و ناهمگن تقسیم میشوند
نانوکاتالیستها، مزایای ترکیبی از هر دو کاتالیست همگن و ناهمگن را دارا میباشند.
| کاتالیزور ناهمگن | نانوکاتالیست | کاتالیزور همگن | ||
| مزایا | فعایت بالا | مزایا | ||
| پایداری بالا | پایداری بالا | فعالیت بالا | ||
| سهولت بازیابی | گزینش پذیری بالا | گزینش پذیری بالا | ||
| سهولت دسترسی | کارایی بالا | زمان واکنش متوسط | ||
| معایب | سهولت جدا شدن | معایب | ||
| فعالیت کم | مقرون به صرفه | پایداری کم | ||
| مدت زمان طولانی واکنش | دوستدار محیط زیست | بازیابی مجدد سخت |
سیستمهای نانوکاتالیکی باعث میشوند تا تغییرات شیمیایی سریع و انتخابی با عملکرد عالی محصول، همراه با سهولت جداسازی و بازیابی کاتالیزور انجام شود. بازیافت کاتالیست از سیستم، یکی از مهمترین ویژگیهای هر کاتالیزور قبل از استفاده در فرایندهای شیمیایی است و از فاکتورهای قابل قبول در شیمی سبز میباشد.
نانوکاتالیست همگن
محلول یا سوسپانسیونی از نانوذرات در یک حلال میباشد، کاتالیزور نسبت به واکنش دهنده در یک فاز میباشد.
زمانی که نانو کاتالیستها برای استفاده در محلول طراحی میشوند لازم است چگونگی جلوگیری از تجمع آنها در نظر گرفته شود، یکی از ویژگیهای نانوذرات تجمع ذرات با یکدیگر و تشکیل تودههای بزرگتر میباشد. اگر از این قضیه جلوگیری نشود نانوذرات مساحت سطح بزرگ خودشان و بقیهی ویژگیهایشان را از دست میدهند.
نانوکاتالیست ناهمگن
کاتالیست، در فاز دیگری نسبت به واکنش دهندهها قراردارد. به دلیل قابلیت بازگشت مجدد آنها، به عنوان کاتالیستهای دوستدار محیط زیست شناخته میشوند، معمولا جامد هستند یا بر روی یک ماتریس بی اثر جامد فعال میشوند. نامحلول بودن در واکنش حلال، به کاتالیزورهای ناهمگن مربوط است و از این رو به راحتی از مخلوط واکنش جدا میشوند.
رفتار نانوکاتالیست همگن چگونه است؟
- کاتالیزور با مخلوط واکنش ترکیب شده و سطح بسیار بالایی از تعامل بین کاتالیزور و واکنش دهندهها وجود دارد
- بر سینتیک واکنش تاثیر میگذارد ولی بر روی حالت تعادل آن بی تاثیر است
- انرژی مورد نیاز برای رسیدن به حالت انتقالی واکنش را کاهش میدهند
- کاتالیز اسیدی، کاتالیز آلی فلزی و کاتالیز آنزیمی نمونههایی از این کاتالیست هستند (اسیدها و بازها، اغلب کاتالیزورهای بسیار موثری هستند زیرا با تاثیر بر قطبش پیوندها، واکنشها را تسریع میکنند)
- باعث افزایش سرعت واکنش(بدون افزایش دما) میشوند، و این ویژگی در کاربردهای صنعتی بسیار موثر است
رفتار نانوکاتالیست ناهمگن چگونه است؟
کاتالیست ناهمگن نیاز به بستری دارد که بتواند واکنش را فعال کند، در نانوکاتالیستها، بستر و کاتالیست، برای رسیدن به بهترين عملكرد با هم تشكیل يک نانوکامپوزيت میدهند بعنوان مثال نانوکاتالیستهای TiO2/Au و Fe2O3/Au کاتالیستهای بسیار خوبی برای اکسايش مونوکسیدکربن (co) به دی اکسیدکربن هستند. استفاده از اين نانوکاتالیست خطرات زيست محیطی مونوکسید کربن را کاهش میدهد.
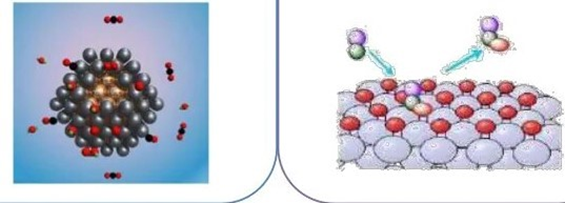
نانو کاتالیست ناهمگن / نانوکاتالیست همگنکاربردهای نانوکاتالیست
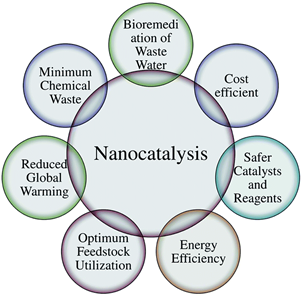
- تصفیه زیستی فاضلابها
- صرفه جویی در هزینه
- کاتالیستهای ایمنتر و واکنش پذیرتر
- بهره وری انرژی
- استفادهی بهینه از ذخایر خوراک
- کاهش گرمایش زمین
- حداقل ضایعات شیمیایی
انواع مواد نانوکاتالیست
- نانولولههای کربنی
- نانوذرات و نانوخوشههای تک فلزی و دوفلزی
- نانوسیمها
- نانوکامپوزيتها و …
خواص ذاتی نانوکاتالیست
- ویژگیهای مکانیکی، فاصله باند یا پیوند، ساختار پیوند، خواص مغناطیسی: بر ترکیب ماده و اکسیداسیون آن موثر است.
- پارامترهای شبکه، چگالی اتمی، انرژی پیوند: بر اندازه، شکل و فاصلهی میان ذرات موثر است.
- انرژی فعال سازی، انتقال فاز: بر حبس وآزاد شدن انرژی کاتالیستها موثر است.
نانوکاتالیستها در صنایع شیمیایی
نانوکاتالیستها در صنایع تجاری و صنعتی مورد استفاده قرار میگیرند. نانوذرات فلزی، نیمه رساناها، اکسیدها و سایر ترکیبات به طور گسترده در واکنش های شیمیایی استفاده میشوند. در صنایع شیمیایی چندین روش برای تهیه انواع کاتالیستهای پشتیبانی نشده وجود دارد که عبارتند از: تبادل یونی، کاهش شیمیایی، XRD (پراش اشعه ایکس)، میکروسکوپ الکترونی روبشی، طیف سنجی فوتو الکترون اشعه ایکس(XPS) و … به عنوان مثال از اکسید نانوفلز مخلوط جامد میتوان به عنوان یک کاتالیزور ناهمگن و قابل استفاده مجدد برای تولید آلکیل استرهای اسید چرب استفاده کرد.
مزایای نانوکاتالیستها در صنایع شیمیایی
- کاهش گرمایش زمین
- بهره وری انرژی
- بهبود اقتصاد
- تصفیه فاضلاب
- حداقل ضایعات شیمیایی
- ایجاد کاتالیزور و معرفهای ایمنتر
- افزایش انتخاب پذیری و فعالیت کاتالیزور با کنترل اندازه منافذ
- جایگزینی کاتالیزورهای فلزات گرانبها توسط کاتالیزورهای ساخته شده در مقیاس نانو باعث بهبود واکنش پذیری شیمیایی و کاهش هزینه میشود
- غشاهای کاتالیزوری میتوانند مولکولهای ناخواسته را از گازها یا مایعات با کنترل اندازه منافذ و ویژگیهای غشا حذف کنند
نانوکاتالیستهای شیمیایی رایج که در صنعت تولید استفاده می شوند عبارتند از: وانادیوم، پلاتین + آلومینا، نیکل، آهن و … به عنوان مثال آلومینیم سیلیکاتها جزء مهم تولید در پتروشیمی مدرن میباشند، همچنین آهن، به عنوان یک کاتالیزور برجسته در تولید آمونیاک استفاده میشود.
نانوکاتالیستها و سوختهای جایگزین
نانوذرات اکسید آهن و کبالت را میتوان بر روی مواد فعال سطحی مختلف مانند آلومین بارگذاری کرد تا با استفاده از فرایند فیشر، گازهایی مانند مونوکسید کربن و هیدروژن را به سوختهای هیدروکربنی مایع تبدیل کرد. تحقیقات زیادی در مورد کاتالیزورهای مبتنی بر نانومواد با حداکثر اثربخشی پوشش کاتالیزوری در سلولهای سوختی انجام شده است، پلاتین در حال حاضر رایجترین کاتالیزور برای این سیستم است. گرچه کمیاب و گران است.
به عنوان مثال نانوذرات تثبیت شده با ایتریوم باعث افزایش کارایی و اطمینان یک پیل سوختی اکسید جامد شدند، یا کاتالیزورهای نانومواد روتنیم/پلاتین به طور بالقوه برای تصفیه و ذخیره هیدروژن استفاده شدند. نانوذرات پالادیوم را میتوان با لیگندهای آلی- فلزی فعال کرد تا اکسیداسیون COو NO را برای کنترل آلودگی هوا در محیط، کاتالیز کند.
کاتالیزورهای پشتیبانی شده از نانولولههای کربنی (یک کاتالیزور جدید که از نانولولههای کربنی به عنوان پشتیبان به جای آلومینای معمولی یا تکیه گاه سیلیکون استفاده می شود) را میتوان به عنوان یک پشتیبان کاتدی برای پیلهای سوختی استفاده کرد و از نانوذرات فلزی برای رشد نانولولههای کربنی استفاده نمود.
نانو کاتالیست و شیمی پایدار (شیمی سبز)
جمعیت جهان میتواند تا سال 2050 به بیش از 9 میلیارد نفر برسد. این افزایش، نیازمند تلاشهای فراوان برای ایجاد سیستمهای تولید پایدارتر است تا از وجود مواد و منابع انرژی کافی در آینده اطمینان حاصل شود. شیمی پایدار یکی از زمینههای اصلی تحقیقاتی است که برای مقابله با چالشهای موجود اختصاص داده شده است. کاتالیز برای شیمی پایدار ضروری است، کاتالیزورها میتوانند اقتصاد را بهبود بخشیده و انتشار خالص گازهای گلخانه ای و حجم زباله مربوطه را کاهش دهند.
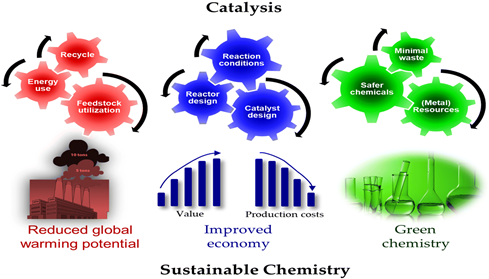
نانوکاتالیز دورهای جدید در شیمی سبز است، افزایش مداوم آلایندهها در محیط زیست، مستلزم توسعهی پایدار صنایع شیمیایی است. نانوکاتالیز این پتانسیل را دارد که با به حداقل رساندن نیازهای انرژی و مواد اولیه، فرایندهای شیمیایی قابل ملاحظه ای را بهبود ببخشد. علاقه روزافزونی برای استفاده از شیمی سبز برای کاربردهای نانوکاتالیز وجود دارد. زمینه استفاده از شیمی سبز برای تجزیه با نانوذرات از سال 2002 تا کنون رشد انفجاری داشته است.
همچنین رشد چشمگیری در زمینه شیمی سبز در شاخهی تولید نانوکاتالیستهای سبز و نیز شرایط سبز در طول تجزیه واکنشهای مهم صنعتی رخ داده است. تهیه نانوکاتالیستهای سبز به سنتز نانوکاتالیستها با استفاده از حلالهای سبز یا پردازش نانوکاتالیستها اشاره میکند تا در نهایت در حلالهای سبز پراکنده شوند.
اندازه معمولی نانوکاتالیستهای سبز 2-3 نانومتر است زیرا این محدوده اندازه، برای بسیاری از واکنشهای کاتالیزوری مطلوب است. البته استثنائات زیادی نیز در این روند کلی وجود دارد و اندازههای بزرگتری از نانوکاتالیستهای سبز نیز برای این اهداف سنتز شده اند.
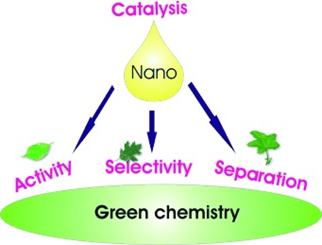
کاتالیز با نانوذرات با استفاده از حلالهای فوق بحرانی با تکنیکهای جداسازی کاتالیزور برای توسعه فرایندهای شیمیایی سبز امیدوار کننده است. نانوکاتالیست های سبز کارآمد مانند (سیلیس، تیتانیوم، پالادیوم، پلاتین، طلا و …) برای چندین واکنش در شرایط چند فازی مناسب هستند. به عنوان مثال نانوذرات سیلیس، ملایم و از نظر محیطی خوشخیم هستند، به عنوان کاتالیزور، برای سنتز پیریدینهای جایگزین استفاده شده اند. این کاتالیزورها پس از سه بار استفاده مجدد ، اکثر فعالیت کاتالیزوری خود را حفظ کردهاند.
کلوئیدها و نانوذرات سیلیس را میتوان به راحتی با استفاده از روش سنتز اِستوبر، سنتز کرده و در آب، که یک حلال سازگار با محیط زیست است پخش کرد. نانوذرات سیلیس سازگار با محیط زیست به عنوان کاتالیزور برای سنتز تیواِترها و وینیل تیواترها استفاده میشوند.
گردآوری و ترجمه: واحد تولید محتوای گروه صنعتی مکرر
منابع:


نظرات (1)
خیلی عالی و جامع بود.
واقعا ممنون